8.6.3. Maddenin Halleri ve Isı Alış-verişi
Önerilen Süre: 6 ders saati
Konu/Kavramlar: Erime/donma ısısı, buharlaşma/yoğunlaşma ısısı, ısınma-soğuma eğrileri
8.6.3.1. Hâl değişimi esnasında ısı alışverişi olduğu sonucuna varır.
Saf maddelerin hâl değişimi sırasında sıcaklığının sabit kaldığına değinilir.
8.6.3.2. Maddelerin hâl değişim ısılarını hesaplayarak sonucu yorumlar.
8.6.3.3. Maddelerin hâl değişim grafiğini çizer ve yorumlar.
8.6.3.4. Günlük yaşamda meydana gelen hal değişimleri ile ısı alışverişini ilişkilendirir.
Maddeler doğada katı, sıvı ve gaz halinde bulunur.
Maddenin hallerini moleküller arasındaki çekim kuvveti belirler.
Isı alan bir maddenin molekülleri arasındaki çekim kuvveti zayıflar, moleküller arasındaki mesafe artar.

Katı maddenin tanecikleri arasındaki çekim kuvveti en fazladır.
Gaz maddenin tanecikleri arasındaki çekim kuvveti en azdır.
Maddenin tanecikleri (atom, molekül veya iyonlar) ısı enerjisi aldıkça tanecikleri arasındaki bağlar kopar.
Molekülü oluşturan atomlar arasında kimyasal bağ vardır. Moleküller arasında da çekim kuvveti bulunur. Bu çekim kuvveti kimyasal bağa göre daha zayıftır. Bir madde ısı aldıkça hareket enerjileri artar, moleküller arasındaki çekim kuvveti azalır.
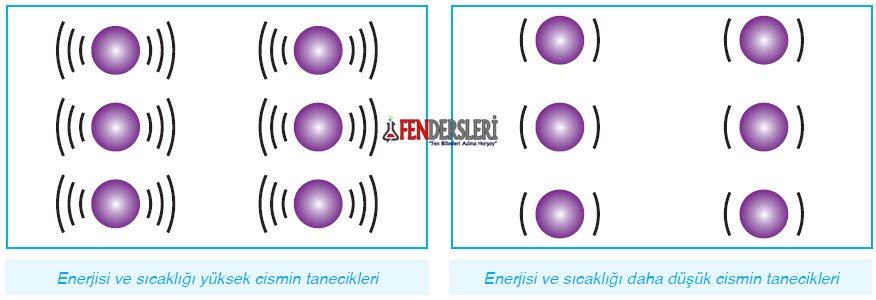
Tanecikler arasındaki çekim kuvveti maddenin halini belirler.
Katı halde; maddenin sıcaklığı azdır, taneciklerin titreşim enerjisi de azdır, tanecikler arası çekim kuvveti fazladır.
Sıvı halde; sıcaklık artmıştır, sıcaklık arttıkça titreşim enerjisi artar, taneciklerin arasındaki çekim kuvveti zayıflar, tanecikler kendi aralarında serbestçe hareket etmeye başlar.
Gaz halinde; sıcaklık daha da artmıştır, titreşim enerjinin çok fazla olmasından dolayı tanecikler artık bir arada duramaz, serbestçe hareket etmeye başlar. Taneciklerin arasındaki çekim kuvveti en azdır.
|
Katı
|
Sıvı
|
Gaz
|
|
|---|---|---|---|
| Tanecikler arası çekim kuvveti |
Fazla
|
Orta
|
Az
|
| Tanecikler arası mesafe |
Az
|
Orta
|
Fazla
|
| Taneciklerin hareket enerjisi |
Az
|
Orta
|
Fazla
|
| Titreşim hareketi |
Var
|
Var
|
Var
|
| Öteleme hareketi |
Yok
|
Var
|
Var
|
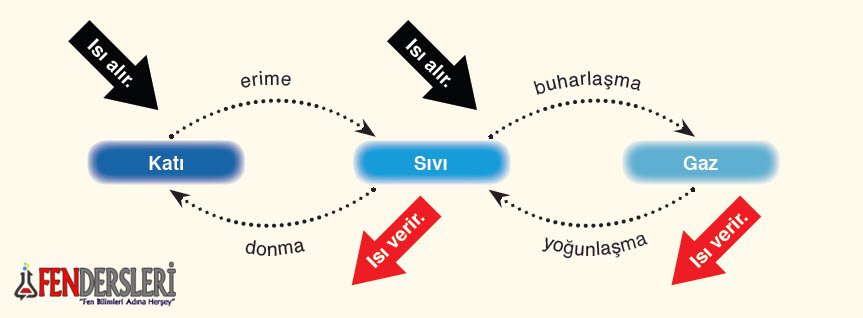
Saf maddeler erime, buharlaşma, kaynama ve süblimleşme sırasında ısı alır.
Saf maddeler donma, yoğuşma ve kırağılaşma sırasında ısı verir.
Saf maddeler erime, donma, kaynama hal değişimleri sırasında sıcaklıkları sabit kalır.
Saf maddeler hal değişimi sırasında aldıkları enerjiyi tanecikleri arasındaki mesafenin artması veya azalması için kullanırlar.
Erime: Maddenin ısı alarak katı halden sıvı hale geçmesine erime denir.
Erime sıcaklığı: Erimenin başladığı sıcaklıktır.
Erime ısısı: Erime sıcaklığındaki 1g maddenin katı halden sıvı hale geçmesi için gereken ısı miktarıdır. Erime ısısı Le ile gösterilir. Birimi j/g dır.
Erime sıcaklığına gelen madde ısı almasına rağmen sıcaklığında bir artış meydana gelmez. Alınan ısı hal değişimi için kullanılır. Taneciklerin arasındaki bağ koparılır.
Erime ısısı maddenin ayırt edici özelliğidir. Farklı maddelerin erime ısıları da farklıdır.
Q=m.Le formülü ile erime ısısı bulunur.
Q: Verilen ısı
m: Kütle
Le: Erime ısısı
| Madde | Erime-Donma Isısı (J/g) |
|---|---|
| Kurşun | 22,57 |
| Demir | 117,04 |
| Bakır | 175,56 |
| Alüminyum | 321,02 |
| Cıva | 11,28 |
| Buz | 334.4 |

Q=m.Le
Q= 20. 334,4
Q = 6688 J ısı alması gerekir.
Donma: Maddenin ısı vererek sıvı halden katı hale geçmesine denir.
Donma sıcaklığı: Maddenin katılaşmaya başladığı sıcaklıktır.
Donma ısısı: Donma sıcaklığındaki 1g saf sıvının katı hale geçmesi için çevreye verdiği ısıdır. Donma ısısı Ld ile gösterilir. Birimi j/g dır.
Bir madde erime ve donma sıcaklıkları aynıdır.
Bir maddenin erime ve donma ısıları aynıdır. (Le=Ld)
Q=m.Ld
Q: Çevreye verilen ısı
m: Kütle
Ld: Donma ısısı
Buharlaşma: Maddenin ısı alarak sıvı halden gaz hale geçmesine denir. Buharlaşma her sıcaklıkta olur.
Kaynama: Sıvının içerisinde gaz kabarcıklarının oluşmasıdır. Kaynama hızlı buharlaşmadır.
Kaynama sıcaklığı: Sıvının kaynamaya başladığı sıcaklıktır.
Buharlaşma ısısı: Kaynama sıcaklığındaki 1g sıvıyı gaz haline geçirmek için gerekli ısıdır. Buharlaşma ısısı Lb ile gösterilir. Birimi j/g dır.
Buharlaşma ısısı maddenin ayırt edici özelliğidir. Farklı maddelerin buharlaşma ısıları da farklıdır.
Q=m.Lb
Q: Buharlaşma için verilmesi gereken ısı
m: Kütle
Lb: Buharlaşma ısısı
| Madde | Buharlaşma-Yoğuşma Isısı (J/g) |
|---|---|
| Su | 2257 |
| Alkol | 854,97 |
| Eter | 296,78 |
| Aseton | 520,41 |
Yoğuşma: Gaz halindeki bir maddenin çevreye ısı vererek sıvı hale geçmesine denir.
Yoğuşma sıcaklığı: Yoğuşma olayının başladığı sıcaklıktır.
Yoğuşma ısısı: Kaynama sıcaklığındaki 1g gaz halindeki maddenin sıvı hale geçerken verdiği ısıdır. Yoğuşma ısısı Ly ile gösterilir. Birimi j/g dır.
Buharlaşma ısısı yoğuşma ısısına eşittir. (Lb=Ly)
Q=m.Ly
Q: Yoğuşurken verdiği ısı
m: Kütle
Ly: Yoğuşma ısısı
Örnek: Yoğuşma sıcaklığında olan bir gazın, yoğuşma ısısı 70 j/g’dır. Bu gazın 210 joule dışarı ısı verdiğinde kaç gramı sıvı hale geçer?
Q=m.Ly
210 = m. 70
m = 210/70
m = 3 gram


Erime maddeler çevrelerinden ısı alırlar.
Donan maddeler çevreye ısı verirler.
Yoğuşma olayı sırasında madde etrafa ısı verir.
Buharlaşma olayının görüldüğü yerlerde soğuma görülür.
Kırağılaşma olayı sırasında madde dışarıya ısı verir.
Not: Saf maddelerin erime ve donma sıcaklıkları sabittir.
Saf maddelerin içerisine yabancı madde ilave edildiğinde erime ve donma sıcaklığı düşer.
Suyun içerisine tuz ilave edildiğinde donma sıcaklığı 0°C nin altına düşer.
Suyun içindeki tuz oranı ne kadar fazla ise donma sıcaklığı da o kadar düşük olur.
Not: Saf maddelerin kaynama sıcaklığı sabittir.
Saf maddelerin içerisine yabancı madde ilave edildiğinde kaynama sıcaklığı yükselir.
Su içerisine tuz ilave edildiğinde, tuz oranına bağlı olarak suyun kaynama sıcaklığı 100°C nin üzerine çıkar.